식품의약품안전처(처장 김강립)는 장애인·환자의 이동 편의성을 높이기 위해서 수동식 휠체어에 부착하는 동력 보조장치를 3월 8일 국내에서 처음 의료기기로 허가했습니다.
‘휠체어 동력 보조장치’는 수동식 휠체어를 동력 보조 휠체어 또는 전동식 휠체어처럼 작동할 수 있게 전환시키는 전기 장치입니다.
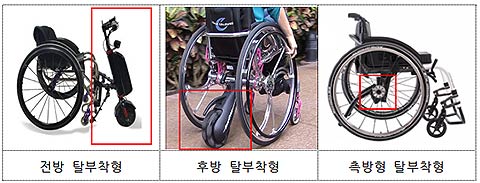
해당 제품은 ㈜알에스케어서비스사(社)가 제조 품목으로 허가 신청한 휠체어 동력 보조장치(제품명: 무브온)로 전방 탈부착형 방식입니다.
이번 제품허가는 법령에 품목분류가 없는 상황에서, 장애인·환자의 이동 편의성 증대를 위해 적극 행정으로 품목 신설부터 허가까지 성과를 도출했다는 점에서 의의가 있습니다.
식약처는 휠체어 동력 보조장치의 ▲안전성·성능 ▲위험관리 ▲사용 시 주의사항에 대해 면밀히 검토해 허가했습니다.
(안전성·성능) 수동 휠체어와 결합하는 제품 특성을 고려해 브레이크 성능, 운전특성(정적·동적 안전성, 최대 속도 등), 피로강도, 결합부위 충격 등 사용자 안전·제품 성능을 심사했습니다.
- 피로강도 : 수동식 휠체어와 결합한 상태에서 요철 등 환경에 노출해 내구성을 확인
(위험관리) 수동휠체어의 특성을 고려해 위험요인을 분석하여 속도제한 등 안전성 확보가 적절히 되었는지 검토했습니다.
* 속도 적정성(6km/h 이하), 경사면 승·하차 시 정지되도록 설계됐는지 등
(주의사항) 사용자에게 제품과 관련된 안전 정보를 충분히 제공하고 있는지를 확인했습니다.
식약처는 휠체어 동력 보조장치 제품화를 위해 ➊규제개선, ➋가이드라인 마련, ➌기술문서 심사기관 교육 등 다방면으로 지원해 왔습니다.
① 먼저, ‘휠체어 동력 보조장치’를 규제 샌드박스 대상으로 지정(’19.2월)하고, 관련규정에 새로운 품목을 신설(’19.11월)했습니다.
② 또한, ‘휠체어 동력 보조장치 허가·심사 가이드라인’을 제정(‘21.4월)해 휠체어 동력 보조장치 제품의 개발·출시를 적극 지원했습니다.
- 허가·심사 가이드라인 : 주요 내용 : ▲적용범위 등 일반사항 ▲휠체어 동력보조장치 분류 ▲안전성·성능시험 규격 ▲위험관리 분석 등
③ 아울러, 올해 2월에는 기술문서 심사기관 7개소에서 휠체어 동력 보조장치 품목을 일관성 있게 심사할 수 있도록 심사 시 검토해야 하는 주요 사항에 대해 교육했습니다.
참고로, 이번 허가 제품과 동등한 제품은 기술문서 심사 후 한국의료기기안전정보원에서 제조·수입인증을 받으면 됩니다.
식약처는 이번 ‘휠체어 동력 보조장치’ 품목 허가로 수동휠체어를 사용하는 장애인·환자의 이동 편의성이 증진될 것으로 기대합니다.
앞으로도 혁신적인 규제 개선과 의료기기 개발·출시에 대한 지원으로 소비자의 편의성을 증진시킬 수 있도록 최선을 다하겠습니다.